Publicada Revisión sobre detección de Trichinella
PUBLICADA UNA REVISIÓN DEL MÉTODO DE AGITACIÓN MAGNÉTICA PARA DETECCIÓN DE LARVAS DE TRICHINELLA
Guillermo E. Delgado de las Cuevas
Veterinario de Salud Pública del Servicio Extremeño de Salud
Vicepresidente de SOCIVESC
Sin lugar a dudas, uno de los agentes patógenos con mayor trascendencia en la veterinaria son los nematodos del genero Trichinella.
Para cientos de colegas, su búsqueda atenta constituye uno de los quehaceres diarios, con el fin de proteger la salud de los ciudadanos.
Su relevancia para la Salud Pública es incluso anterior al propio descubrimiento del parásito. Así, probablemente sea una de las causas que determinaron la consideración del cerdo como animal "impuro" por algunas religiones, al relacionar el consumo de su carne con la enfermedad en las personas; si bien, existen otras diferentes como la competencia por el alimento en regiones desérticas, y otras que no vienen al caso comentar.
Desde su descubrimiento en 1835 por el joven estudiante de medicina J. Paget, y tras la "apropiación indebida" del mismo por el ávido R. Owen, Trichinella no ha dejado de ganar importancia. Baste el ejemplo de su utilización como “excusa” en las guerras comerciales entre los EE UU y la vieja Europa para prohibir las importaciones de carne porcina a finales del siglo XIX.
Por ello, la implantación de la moderna inspección veterinaria, tal y como la conocemos hoy en día, le debe mucho también a este nematodo.
Como le gustaba mencionar al profesor I. Navarrete (D.E.P.): la veterinaria debería hacerle un monumento a la Trichinella; y, lejos de caer en el olvido, las especies de este parásito continúan siendo una preocupación para las autoridades sanitarias.
Su amplio rango de hospedadores, especialmente entre los animales silvestres, como el zorro y el jabalí, en nuestro entorno, la gravedad de la enfermedad para las personas, los hábitos de consumo de productos curados elaborados con carne cruda derivados del cerdo y de las especies cinegéticas, hacen necesario un diagnóstico preciso a la vez que sensible, de la posible presencia de larvas infestantes en la carne de los animales.
Además, la detección de especies no encapsuladas en la musculatura, T. pseudospiralis (T4), en nuestro país por primera vez en el año 2014, (Zamora et al., 2015), y la más que probable aparición de nuevos casos de esta especie a corto plazo, hacen necesario que las técnicas utilizadas para su detección gocen de la mayor fiabilidad y robustez.
Hoy en día, la técnica más usada es la digestión artificial pépsica de la carne asistida por agitación magnética, que presenta grandes ventajas sobre la hasta ayer tan manida por el uso, de triquineloscopia por compresión en placa de trozos musculares.
Es por esto, que es “vital” conocer todos los aspectos relacionados con este método diagnóstico para nuestra profesión veterinaria. Por ello, al tener conocimiento de la publicación del trabajo científico del equipo de Mayer-Scholl et al. (2017), desde SOCIVESC pensamos que debe dársele la máxima difusión. Por tanto, además de publicar el enlace a este interesante artículo, adjuntamos una traducción con el fin de facilitar su comprensión y asimilación, ¿o deberíamos decir digestión?
A continuación el artículo traducido:
Traducción libre de: Mayer-Scholl, A., Pozio, E., Gayda, J., Thaben, N., Bahn, P., Nöckler, K. Magnetic Stirrer Method for the Detection of Trichinella Larvae in Muscle Samples. J. Vis. Exp. (121), e55354, doi:10.3791/55354 (2017).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5409328/ (enlace al artículo original).
En color azul: comentarios al texto del artículo de Mayer-Scholl et al. Las figuras mencionadas se encuentran en el texto original, aunque se han traducido los pies de las fotografías (al final del texto).
MÉTODO DE AGITACIÓN MAGNÉTICA PARA DETECCIÓN DE LARVAS DE TRICHINELLA EN MUESTRAS MUSCULARES Mayer-Scholl, A., Pozio, E., Gayda, J., Thaben, N., Bahn, P., Nöckler, K.
RESUMEN
La triquinosis o triquinelosis es una enfermedad debilitante de las personas causada por el consumo de carne cruda o poco cocinada de animales infestados con larvas de nematodos del género Trichinella. Las fuentes más importantes para infestación en las personas en todo el mundo son la carne de caza, la carne de cerdo, o los productos derivados del cerdo.
En muchos países, la prevención de la triquinelosis en las personas se basa en la detección de animales infestados mediante técnicas de digestión artificial de muestras musculares de carnes (canales), de animales susceptibles.
Existen varios métodos basados en la digestión de la carne, pero el basado en agitación magnética es considerado el método de referencia (gold standard). Este método permite la detección de larvas de Trichinella con el microscopio después de la digestión enzimática de muestras musculares y las fases subsiguientes de filtración y sedimentación (decantación). Aunque este método no precisa de un equipamiento caro y especial (aproximadamente 1800 euros), no se pueden utilizar controles internos. Así, durante la prueba, deberían aplicarse sistemas rigurosos de control de calidad. El propósito de este trabajo es proporcionar instrucciones de manejo detalladas y puntos de control críticos del método dirigido a los analistas, basados en las experiencias del Laboratorio de Referencia para Parásitos de la UE (en Roma, Italia) y el Laboratorio Nacional de Referencia de Alemania para Trichinella (Berlín).
ENLACE A VIDEO
Un video de apoyo a este artículo puede verse en https://www.jove.com/video/55354/
El video, resulta muy ilustrativo, por lo que recomendamos su visualización.
INTRODUCCIÓN
Los nematodos del género Trichinella, se han detectado en musculatura estriada de mamíferos carnívoros y omnívoros, aves y reptiles a nivel mundial. Estos nematodos zoonóticos pueden infestar a las personas cuando se consume carne o productos cárnicos crudos o poco cocinados de porcinos, equinos o animales de caza. Esta zoonosis puede ser una enfermedad grave para las personas, con signos y síntomas (casi), patognomónicos, por ej. diarrea, fiebre, edema periorbital, mialgias; con posibilidad de complicaciones como miocarditis, tromboembolismos y encefalitis, (siempre asociados al consumo de carne).
Trichinella spiralis (T1), es la especie más ampliamente distribuida, entre los animales domésticos y la fauna silvestre. Causa la mayoría de las infestaciones humanas en todo el mundo. En Europa, África del Norte y Occidental, y el Oeste de Asia, T. britovi (T3), causa (también) importantes brotes en personas. Además, existen otros 10 taxones, menos frecuentemente hallados, como causantes de enfermedad humana, y se encuentran en diferentes zonas del mundo, normalmente entre la fauna salvaje. Junto con los animales silvestres, tales como jabalí, osos, morsas y tejones, el cerdo representa la fuente más importante de infestación para las personas. En nuestro país se considera que el jabalí y el zorro son los principales responsables de mantener el ciclo silvestre.
El mejor modo de prevenir la triquinelosis es abstenerse de consumir productos cárnicos crudos y cocinar adecuadamente cualquier carne, especialmente la de especies cinegéticas, a temperaturas consideradas seguras (> 65ºC durante 1 minuto, ej. cambio de coloración del rosado a marrón, en el centro de la pieza cárnica). La UE y los EEUU (USDA), han especificado temperaturas y tiempos de congelación y cocinado para productos del cerdo que se pueden utilizar para matar las larvas de T. spiralis en la carne. Además, la Comisión Internacional de Triquinelosis (ICT), ha publicado recomendaciones para la inactivación de Trichinella en la carne y los productos cárnicos. En Europa, junto con la introducción de condiciones controladas de estabulación en explotaciones de cerdos comerciales, donde el riesgo de infección por Trichinella es insignificante, la prevención de la triquinelosis se basa en el examen laboratorial de muestras de musculatura de animales susceptibles.
Los métodos basados en la digestión son los únicos procedimientos fiables (lo suficientemente sensibles y específicos) para la detección directa de larvas de Trichinella en la carne con el fin de obtener alimentos inocuos (salubres). Incluso si existen algunas variaciones en los métodos de digestión, el método de agitación magnética es reconocido internacionalmente como el método de referencia. Este análisis está basado en la detección de larvas de Trichinella en el tejido muscular estriado. Después de la digestión enzimática de las muestras de músculos y las fases siguientes de filtración y sedimentación (decantación), las larvas de Trichinella son identificadas mediante microscopía. Dependiendo de los requisitos comerciales y la legislación nacional, existen variaciones en el protocolo general del método de agitación magnética. En este artículo, los detalles técnicos están basados en los requisitos de la UE, especificaciones ISO, guías ICT (International Commission on Trichinellosis) y las experiencias de los Laboratorios de Referencia de la UE para Parásitos y del Laboratorio de Referencia de Alemania para Trichinella.
PROTOCOLO
- PREPARACIÓN
- Recogida de Muestras
Nota: El método de agitación magnética puede ser utilizado para muestras simples o grupos de muestras.
- Recoger muestras de los lugares de elección adecuados y en cantidades suficientes. Referidos a los requisitos de cada país o a las recomendaciones de ICT, OIE, o ISO.
- Para la UE, por ej. recoger 1 g de muestras de los pilares del diafragma en la transición de la parte muscular de los cerdos domésticos (zona de transición entre la parte muscular y tendinosa). Asegurar que todas las muestras de músculo están libres de grasa o fascias.
- Si se utiliza la lengua, retirar la capa superficial , previamente.
- Tener cuidado si las muestras están congeladas, la mayoría de las larvas de Trichinella no son resistentes a la congelación y se desenroscan (“desespirilizan”), tras la muerte, son menos resistentes a la digestión y tienen tendencia a adherirse a las paredes del contenedor, produciendo una disminución en la sensibilidad del análisis. (sumado a la dificultad de la visualización y diferenciación con fibras musculares digeridas parcialmente).
En alguna ocasión, la adherencia de larvas de muestras congeladas fue tal, que no apareció hasta dos procesos posteriores de digestión de carnes negativas, provocando un falso positivo. Pero la larva se encontró “desespiralizada” y sin contenido observable interior (esticocitos), indicativo de que larva estaba muerta un tiempo antes. Por ello, es también fundamental hacer énfasis en los procesos de limpieza/descontaminación del equipo tras encontrar resultados positivos a Trichinella.
Nota: Con muestras de carne congeladas, al menos, doblar la cantidad de la muestra e incrementar el tiempo de sedimentación (ver debajo).
- Preparación del líquido de digestión
- Añadir HCL al 25%º (16 ± 0.5 ml) a 2 L de agua corriente precalentada a 46-48ºC en un vaso de precipitados de 3 L. Las temperaturas demasiado bajas producen digestiones incompletas; las temperaturas demasiado altas desactivan las propiedades enzimáticas de la pepsina (junto con la posibilidad de coagulación de las proteínas y/o floculación, además de matar las posibles larvas existentes).
- Colocar una barra de agitación en el fondo del vaso de precipitados (imán recubierto de teflón), y agitar la solución en una placa precalentada (46-48ºC).
- Añadir 10 ± 0,2 g de pepsina (1:10.000 NF, US National Formulary, 1:12.500 BP, British Pharmacopeia, 2.000 FIP, Féderation Internationale de Pharmacie, a la solución ácida.
Nota: la calidad de la pepsina es de la máxima importancia y la actividad enzimática tiene que estar certificada por el fabricante. Por razones de seguridad en el laboratorio y para mantener la actividad de la pepsina, debe seguirse (rigurosamente) la secuencia de la adición de los componentes para la preparación del líquido de digestión. (existe pepsina líquida en el mercado para evitar reacciones alergias en profesionales sensibles).
3. Preparación de la muestra muscular
- Picar 100 g de muestras de músculo en una picadora o licuadora. Para facilitar el picado, añadir 2 ml de agua precalentada a las muestras y picar a la máxima velocidad durante 2-3 segundos.
- Antes del segundo picado, abrir la picadora y pasar cualquier muestra de músculo de la parte superior del borde marginal del vaso de la picadora al fondo y repetir el picado. Continuar con el picado en períodos de 2-3 segundos hasta que no aparezcan trozos visibles de carne.
Nota: Los picados ligeros pueden producir digestiones incompletas, mientras que picados excesivos podrían dañar las larvas de Trichinella presentes en las muestras.
- PROCEDIMIENTO
- Digestión de muestras musculares
- Transferir 1 L del líquido a una probeta. llevar la masa de carne picada al vaso de precipitados y disolverla (repartirla) en el líquido de digestión con una cuchara o un tenedor. Enjuagar concienzudamente la tapa de la picadora, la cuchilla y el vaso de la picadora con 500 ml del líquido de digestión precalentado en el vaso de precipitados de 3 L. (Y luego añadir el resto de solución de digestión al vaso de precipitado para completar los 2 L).
- Digestión de muestras musculares
Nota: Un enjuagado incompleto puede producir una pérdida de sensibilidad (por pérdida de carne triturada).
- Cubrir el vaso de precipitados con una hoja de papel de aluminio y mantener una temperatura constante de 44-46ºC y vigilar con un termómetro.
- Agitar el líquido de digestión durante 30 minutos hasta crear un profundo remolino sin salpicaduras hasta que las partículas de carne desaparezcan. Dependiendo del tipo de carne analizada (ej. carne de animales silvestres), aumentar el tiempo de digestión hasta un máximo de 60 minutos. (Para jabalí se suele recomendar 45 minutos, para zorros y osos, cerca de 60 minutos, pero hay que tener en cuenta que en ese caso, se podrían dañar las larvas con facilidad a causa de la prolongación del proceso de digestión).
- Filtración y sedimentación del líquido de digestión
- (decantación). Comprobar que el embudo de separación se encuentra nivelado verticalmente.
- (de malla), dentro del embudo de separación de vidrio. La anchura de este embudo no debería ser mayor que el 55 % de su altura para permitir una buena sedimentación de las larvas. Tener cuidado para evitar desbordamientos.
- Para evitar pérdida de sensibilidad, enjuagar concienzudamente el vaso de precipitados y el tamiz con aproximadamente 200 ml de agua corriente mediante un frasco lavador dotado de pipeta flexible, y traspasar el agua de enjuagado al embudo de sedimentación de vidrio. Tener cuidado de enjuagar cuidadosamente los bordes del vaso de precipitados de 3 L. Levantar el tamiz y enjuagar el área bajo el tamiz concienzudamente.
3. Determinación de la cantidad de tejido no digerido
Nota: Debido a los errores a la hora de realizar el método, pueden permanecer en el tamiz porciones de tejido muscular, igualmente en el caso de fascias y tejido conjuntivo indigerible. La cantidad de tejido no digerido se determina durante los primeros 10 minutos de la fase (final) de sedimentación (tras la decantación de 30 minutos, para que dé tiempo suficiente a que escurra y se filtre todo el líquido remanente en el tamiz y la carne quede “seca” y no se pese agua por musculo), (véase 2.5, “Sedimentación del líquido de digestión en la probeta”). Esto permite aproximadamente 30 minutos para que el filtro se seque, ya que el agua residual puede influir sobre la determinación del peso del tejido no digerido.
- Colocar una hoja de papel secante en la balanza y pesar el tamiz con los tejidos no digeridos.
- Restar el peso del tamiz antes de la filtración del peso del tamiz con los tejidos no digeridos. Se considera que el proceso de digestión es satisfactorio si no permanece más del 5 % del peso de la muestra inicial en el tamiz (ej. 5 g/100 g del material inicial).
- Si la cantidad de tejido no digerido supera el 5 % repetir el análisis con muestras de músculo frescas. Si el tejido que permanece está compuesto principalmente de tejido muscular no digerido y no se dispone de muestras frescas, digerir nuevamente el tejido no digerido y examinar junto con las muestras originales.
- Mantener el líquido de digestión filtrado en el embudo de decantación durante 30 minutos. Si se deja sedimentar, las larvas de Trichinella se asentarán en el fondo del embudo.
- Si las muestras estaban congeladas, aumentar el tiempo de sedimentación hasta un máximo de 60 minutos.
- Una vez completada la sedimentación, abrir completamente la llave de paso del embudo de decantación y traspasar rápidamente al menos 40 ml del líquido a una probeta graduada (80 ml si las muestras de músculo eran congeladas). (Nota: Hacerlo según el punto 4 siguiente).
- Primero, traspasar la mitad de líquido a la probeta (por ej. 20 ml) y luego abrir la llave de paso en la dirección contraria para permitir el paso de 10 ml de líquido de digestión. Finalmente abrir la llave de paso en la otra dirección para pasar otros 10 ml. Este procedimiento asegura que no quedan atrapadas larvas de Trichinella en la llave de paso.
Nota: Se necesita suficiente velocidad para evitar que permanezcan larvas en el embudo de separación, disminuyendo la sensibilidad de la prueba.
- Dejar que el líquido repose en la probeta durante 10 minutos, para permitir que las larvas sedimenten. Retirar 30 ml de sobrenadante succionándolo con una pipeta sin remover los 10 ml del fondo.
- Para reducir la cantidad de fibras de tejidos en la muestra, añadir 30 ml de agua al sedimento y dejar reposar otros 10 minutos. Repetir (sucesivamente) este paso hasta que el líquido esté claro. (En el reglamento UE 2015/1375, “por el que se establecen normas específicas para los controles oficiales de la presencia de triquinas en la carne”, se permite clarificar solo de 2 a 4 veces, ya que se podría producir una pérdida de larvas y por tanto perder sensibilidad).
- Remover el sobrenadante y transferir los 10 ml del sedimento lavado a una placa de Petri cuadriculada o a una cubeta de recuento. Aclarar la probeta con 10 ml de agua corriente y añadir el agua a la muestra.
Nota: Grandes cantidades de residuos pueden evitar la identificación de las larvas de Trichinella. (Fig. 1), por lo que debería entonces, realizarse más pasos de aclarado si son necesarios.
- Utilizar un triquinoscopio o un estéreo-microscopio con una fuente de luz transmitida por debajo de la platina de intensidad regulable a 15 a 20 aumentos para examinar las muestras inmediatamente tras las fases de enjuagado.
- Después de verter el sedimento en la placa de Petri cuadriculada o en la cubeta, examinar de manera sistemática cuadro por cuadro la cubeta/placa si no se encuentran formas sospechosas, mover suavemente de manera circular la cubeta o placa de Petri, para permitir que cualquier larva de Trichinella que se hubiera podido pasar por alto, se acumule en el centro de la placa, y repetir el examen.
- Si se encuentran formas sospechosas, incrementar los aumentos (del microscopio), a 40-100. Recoger las larvas de Trichinella de la cubeta/placa de Petri con una pipeta y traspasarlas a un tubo con etanol al 90 %.
- Después de examinar toda la placa, repetir el procedimiento empezando tras el suave agitado de la placa/cubeta. Repetir el procedimiento al menos tres veces o hasta que no se encuentren más larvas.
- Contar el número de larvas. Correlacionar la cantidad de tejido muscular analizado para determinar el número de larvas por gramo (lpg).
- Si se encuentran demasiadas larvas en el líquido de digestión, para poder determinar el número de manera fiable, devolver el líquido con las larvas a la probeta, aclarar con agua corriente de una botella de lavado y dejar que las larvas se sedimenten en el fondo.
- Tras un tiempo de 10 minutos de sedimentación, reducir el sobrenadante hasta un volumen definido (ej. 10 ml). Para determinar el volumen exacto, transferir el sobrenadante a una probeta graduada con una pipeta.
- Mezclar homogéneamente las larvas en el líquido mediante una agitado vigoroso. Durante el agitado, añadir (tomar y transferir), 12 gotas de 20 μl de la suspensión con las larvas a una placa de Petri.
- Examinar mediante microscopio cada gota. Determinar el número de larvas en 240 μl y desechar, los valores máximos y mínimos. Extrapolar el número de larvas al volumen total (ej. 10 ml) de sobrenadante.
Nota: la calidad del estéreomicroscopio es de importancia capital para la identificación de larvas de Trichinella.
- Cuando se recogen larvas en un tubo con una pipeta, comprobar cuidadosamente que las larvas no se adhieren a las paredes de la pipeta y se transfieren al tubo.
Nota-. Hallazgos positivos de Trichinella en grupos de muestras, deben trazarse hasta descubrir la canal/animal de origen. Así, los grupos de muestras deberían ser reducidos progresivamente hasta que se identifique la canal positiva. Durante este proceso, el tamaño de la muestra se puede aumentar para incrementar la sensibilidad. Cuando el examen de un grupo de muestras produce resultados positivos o dudosos, deberán tomarse muestras de más de 20 g por cada cerdo. Se agrupan 20 g de 5 cerdos y se examinan siguiendo el método descrito. De este modo, se examinaran muestras de 20 grupos de 5 cerdos. Cuando se detecta Trichinella en un grupo de muestras de 5 cerdos, se toman muestras de 20 g de cada cerdo individualmente y cada una se examina de manera independiente hasta que se detecta la canal positiva.
RESULTADOS REPRESENTATIVOS
Después de la digestión, la forma de la larva infectante, puede variar, dificultando la identificación. Las formas típicas incluyen larvas fuertemente espiralizadas (enroscadas), larvas ligeramente espiralizadas, con forma de “C” o completamente desespiralizadas (Fig. 2B-2C). El número de larvas encontradas por gramo puede variar considerablemente y el intervalo puede ir desde una a unos pocos de cientos de larvas.
Se muestra la morfología de la larva en la fig. 2A. Las larvas de Trichinella miden de 0,7 a 1,5 mm de largo y aproximadamente 0,3 mm de ancho. El esófago es estrecho y tiene un extremo posterior ligeramente redondeado. La cutícula es lisa. En la mitad anterior de la cavidad del cuerpo, se puede observar el esticosoma, una estructura constituida por un tubo delgado y largo rodeado de 45 a 55 grandes células (esticocistos). El recto también es redondeado sin ninguna proyección o apéndices.
Otras estructuras, distintas de larvas de Trichinella, se pueden encontrar tras la digestión de la musculatura. Se muestran algunos ejemplos en las Fig. 3A-3F Los animales silvestres están frecuentemente infestados con otros parásitos, o las muestras musculares disponibles para los análisis se contaminan durante el proceso de evisceración con organismos o estructuras animadas o inanimadas. La longitud de las larvas, la apariencia de los extremos anteriores y posteriores (sin espículas) y la observación del esticosoma, sirven de ayuda para diferenciar los distintos géneros de nematodos.
DISCUSIÓN
Aunque el método de agitación magnética se puede realizar fácilmente, un seguimiento no demasiado estricto de la técnica, producirá una sensibilidad insuficiente, por tanto, poniendo en riesgo la salud del consumidor. Los puntos de control críticos se han señalado en el texto anterior. Además, el uso de un equipo adecuado es crucial para lograr con éxito resultados del test. Todos los recipientes deberían ser de vidrio y las puntas de las pipetas recubiertas con silicona para reducir la adherencia de las larvas a sus superficies.
La sensibilidad del método de digestión depende de la densidad de las larvas en los músculos y la cantidad de muestras de músculo analizadas. Para una densidad larvaria de 3-5 lpg de tejido muscular, se han declarado sensibilidades del 100 %, pero por debajo de 1 lpg la sensibilidad desciende al 40 %. Dependiendo de la especie del hospedador animal analizada, la sensibilidad se puede mejorar incrementando la cantidad de muestra utilizada. La carga parasitaria en la fauna silvestre es con frecuencia baja, por tanto, se utilizan cantidades mayores de muestras. Los lugares de elección (para recoger la muestra) varían entre las distintas especies de hospedadores. Por eso, la baja digestibilidad de algunos tejidos musculares, tales como la lengua, deben ser tenidos en cuenta, lo cual puede requerir mayores cantidades de muestra.
Más aún, es importante entender que el método de agitación magnética no incluye controles internos (controles para falsos positivos o negativos de otras técnicas). Así, sistemas que aseguren la calidad desde la toma de muestras hasta la documentación, son esenciales para obtener resultados exactos y precisos. La calidad de los procedimientos del laboratorio para detectar larvas de Trichinella en muestras de músculo, debe ser comprobada de forma regular mediante la participación de cada analista en pruebas de competencia (testajes en ciego).
Otras limitaciones de la técnica son que la identificación final del estadio de la larva (L1) mediante microscopia es muy subjetiva y altamente dependiente del conocimiento de la morfología larvaria por parte del analista.
Un método alternativo para evitar este problema es el método de agitación magnética/aislamiento por filtración seguido de detección de larvas mediante técnica de aglutinación en látex. Sin embargo, y según la normativa de la UE, este método solo se considera equivalente para carne de cerdos domésticos, pero no para animales con alto riesgo de infección, como el jabalí. La identificación del antígeno de la larva con anticuerpos monoclonales, hace al test más objetivo, pero no permite determinar el número de larvas por gramo. (ni la identificación genética de la especie parásita involucrada).
Otras variaciones al método de agitación magnética incluyen método de digestión de muestras colectivas con asistencia mecánica/técnica de sedimentación, el método de digestión de muestras colectivas con asistencia mecánica/técnica de aislamiento por filtración, y la digestión automática para muestras colectivas de hasta 35 g. Todas estas técnicas se basan en el método de digestión artificial de la carne y la visualización y recuento de larvas de Trichinella, pero difieren en los equipos utilizados para las fases de filtración y sedimentación.
Las larvas aisladas pueden luego ser identificadas a nivel de especie mediante técnicas moleculares (ej. Multiplex-PCR). De acuerdo con la normativa de la UE, las muestras positivas deben ser enviadas al Laboratorio Nacional de Referencia o el Laboratorio de Referencia para Parásitos UE, para la determinación de la especie de Trichinella.
Declaración, Agradecimientos y bibliografía ver en el artículo original.
Traducción de pies de fotografías (figuras) que aparecen en el artículo original (ver en enlace):
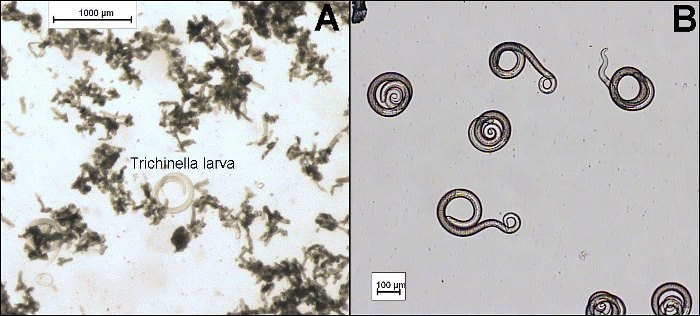
Figura 1: Examen microscópico de larvas de Trichinella después de un (A) enjuagado/aclarado insuficiente o (B) enjuagado/aclarado suficiente.

Figura 2: Morfología de larvas infestantes de Trichinella, mostrando el recto, esófago y esticosoma de la larva (A). Posibles formas de las larvas musculares tras la digestión mostrando (B) larvas en movimiento fuertemente enrolladas y ligeramente enrolladas y (C) larva desenrrollada (la última de la derecha).

Figura 3: Ejemplos de hallazgos accidentales tras la digestión de muestras de musculatura con el método de agitación magnética. (A). Lombriz de tierra con estructura de cerda (pelo) de jabalí; (B) Alaria alata (trematodo) de jabalí; (C) Fibra muscular de jabalí; (D) Metastrongylus sp. de jabalí; (E) Fibra vegetal encontrada en jabalí; (F) Larva de Toxocara sp. de jabalí.
Para saber más:
- Sáiz Moreno, L. (1987). Historiografía de dos importantes zoonosis: triquinosis y lepra (cisticercosis porcina). II. Lepra del cerdo y/o cisticercosis porcina. Revista de sanidad e higiene pública, 61(11-12), 1147-1158.
- Campbell, W. (Ed.). (2012). Trichinella and trichinosis. Springer Science & Business Media.
- Zamora, M. J., Alvarez, M., Olmedo, J., Blanco, M. C., & Pozio, E. (2015). Trichinella pseudospiralis in the Iberian peninsula. Veterinary parasitology, 210(3), 255-259.
Agradecimientos al Dr. Rafael Calero Bernal por sus apreciaciones y contribuciones.


